El sector "pharma-biotech" ante la crisis COVID-19: primeras lecciones
La pandemia causada por COVID-19 se ha generado en un tiempo extremadamente corto. Desde el primer caso reconocido por la OMS, el 8 de diciembre de 2019, y en aproximadamente tres meses, se han contabilizado (a fecha de 15 de Marzo) 157.648 infectados y 5.746 fallecidos. En nuestro país, desde la confirmación del primer contagio en La Gomera el 1 de febrero, hemos llegado en apenas mes y medio a 7.700 infectados y aproximadamente unos 300 fallecidos. Este perfil de propagación, así como los efectos deletéreos sobre algunos grupos de población, ha obligado a la adopción de medidas severas de confinamiento de la población.
De todas formas, en algunos países, se está planteando la posibilidad de implementar medidas más laxas de confinamiento y favorecer, así, el desarrollo de la denominada inmunidad de grupo que permita acelerar la desaparición del agente infeccioso, como es el caso de Reino Unido. Esta estrategia sería más beneficiosa para minimizar los efectos económicos de la pandemia, pero según los propios expertos en Inglaterra, dará lugar al colapso de los hospitales y un elevado coste en vidas humanas.
Como se suele decir, en medio de toda crisis reside la semilla de nuevas oportunidades. Pues bien, desde el punto de vista de la gestión farmacéutica podríamos destacar 3 áreas en las que esta crisis puede aportarnos aprendizajes que servirán para afrontar futuras crisis sanitarias:
1. El primero tiene que ver con los productos sanitarios necesarios para el correcto desarrollo del trabajo del personal involucrado en la atención a los pacientes infectados por coronavirus. Fundamentalmente, estos productos sanitarios incluyen los elementos de protección (mascarillas, guantes, batas, etc.) y equipos particulares de soporte vital como los respiradores artificiales. Estos elementos, en líneas generales, están siendo suministrados con normalidad en centros sanitarios; aunque ha habido casos puntuales de ruptura de stock que podrían generalizarse en las próximas fechas. Esta crisis ha puesto de manifiesto la carencia de fabricantes locales a nivel español y europeo de este tipo de materiales que, como estamos viendo, son estratégicos para la Unión Europea. El Gobierno de España, a través del Ministerio de Sanidad, ha centralizado la compra de estos suministros, pero son evidentes ya las demandas de más material por parte de profesionales sanitarios y algunas comunidades autónomas. La fabricación de este tipo de producto sanitario no es tan sencilla como se pudiera pensar, ya que todo producto sanitario debe pasar un proceso regulatorio de aprobación y de validación clínica. La definición de producto sanitario incluye, de forma simplificada, todos los productos utilizados en la asistencia sanitaria que no son medicamentos, de muy diferente naturaleza y finalidad. En esta categoría de productos entrarían todos estos materiales de protección así como los productos de diagnóstico in vitro. Son por tanto una categoría de productos de vital importancia en esta crisis, de hecho, en los momentos actuales, son más estratégicos que los potenciales medicamentos o vacunas que llegarán seguro a desarrollarse a medio plazo.
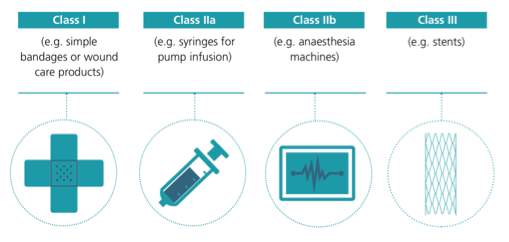
Figura 1. Clasificación de los productos sanitarios (MedTech Europe; 2017/745/EU).
Es importante entender que estos productos, precisamente por ser tan relevantes a la hora de asegurar la seguridad de los médicos y profesionales, deben responder a unos requerimientos de calidad y regulatorios. Por este motivo, los procedimientos de aprobación son más largos y complejos de lo que a priori se podría pensar desde la opinión pública. Los productos sanitarios (Figura 1) se regulan por una reglamentación sanitaria armonizada en la Unión Europea. El fabricante, europeo o no, que quiere comercializar uno de estos productos sanitarios en Europa, se dirige a un organismo de evaluación europeo, los llamados organismos notificados, presentando una documentación sobre el diseño, los procesos de fabricación y esterilización, las pruebas de funcionamiento, los ensayos clínicos, los materiales de envasado, las normas técnicas que cumplen y la información que acompaña al producto. El organismo notificado evalúa esa documentación y efectúa una auditoria en las instalaciones donde se fabrica el producto. Si el resultado de las comprobaciones es favorable, emite un certificado de conformidad que permite colocar el número de organismo notificado junto con el distintivo CE en el producto, lo que indica que cumple con los requisitos de la reglamentación. Con este marcado puede comercializarse en todos los países de la Unión Europea sin necesidad de nuevas evaluaciones. Puede comprenderse que en esta crisis dependemos de los fabricantes que ya tienen la aprobación regulatoria para la fabricación de este tipo de productos y que no es sencillo ni inmediato el poner a trabajar nuevas fábricas.
La Figura 2 muestra el número de empleados en empresas de tecnología sanitaria (MedTEch) por 10.000 habitantes en diferentes países de Europa. España es de los países que menos empleo tienen en esta área y es importador neto de productos sanitarios por lo que será estratégico impulsar la creación de empresas en esta área de la salud (tengamos presente que el 95% de las empresas MedTech son pequeñas y medianas empresas). En FENIN (Federación Española de Empresas de Tecnología Sanitaria) aparecen registradas actualmente en España 65 empresas fabricantes, importadoras y distribuidoras de Productos Sanitarios diseñados y destinados a utilizarse una sola vez.
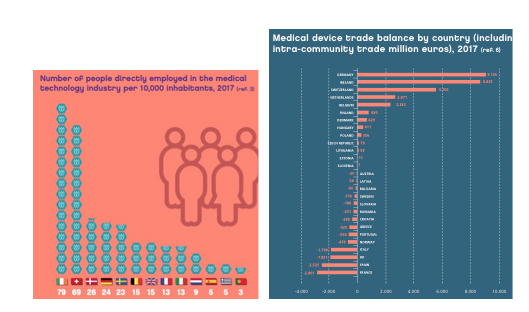
Figura 2. Personas empleadas en la industria de los productos sanitarios en 2017 (expresado en número de personas por 10000 habitantes). Balance comercial en productos sanitarios por países.
2. Un segundo aspecto es el relativo a los sistemas de diagnóstico del COVID-19. En este punto, hay que reconocer que la industria biofarmacéutica española ha sido puntera y rápida poniendo en el mercado varios kits de diagnóstico del COVID-19 que se están utilizando ya en nuestro país y en diferentes países europeos. Los productos de diagnóstico son también productos sanitarios, que se pueden clasificar en 4 tipos diferentes (Figura 3).
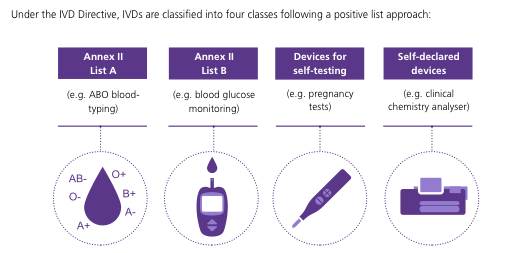
Figura 3. Clasificación de los productos de diagnóstico (IVD Directiva; 2017/746/EU).
La empresa española Genomica, del grupo Pharmamar, comercializó el 6 de marzo dos test de diagnóstico para COVID-19 validados clínicamente en muestras de pacientes en colaboración con el Instituto Carlos III de Madrid, tal como requieren las autoridades sanitarias. Esto ha sido posible al disponer la empresa de 21 test diagnósticos de virus respiratorios, incluyendo 3 coronavirus (HCoV-229E, HCoV-OC43 and HCoV-NL63). Este conocimiento previo ha sido fundamental a la hora de poder desarrollar de forma rápida un test de diagnóstico para el nuevo conoravirus. Aunque el desarrollo de un test diagnóstico es más complejo que el de diseño y aprobación de materiales desechables, España ha sido capaz de ofrecer productos validados en tiempo record al disponer del conocimiento y del equipamiento científico e industrial.
Otra compañía española que ha desarrollado tests de diagnóstico para COVID-19 ha sido CerTest Biotech, una empresa que colabora con la Universidad de Navarra, en colaboración con la empresa BD (Becton, Dickinson and Company). La prueba se basa en la reacción en cadena de la polimerasa en tiempo real (PCR), identificando y amplificando una secuencia específica del DNA del virus en muestras clínicas. Este test comercializado por BD en Europa (no disponible para Estados Unidos) funcionará sobre las plataformas de diagnóstico ya instaladas en los hospitales. Es importante recordar que el impacto clínico de disponer de estos test diagnósticos es inmenso, al permitir a los médicos la identificación rápida y fiable de los pacientes con COVID-19 y proceder a su aislamiento y adecuado tratamiento, así como la certificación de los pacientes que han superado la enfermedad. Para poner en perspectiva este logro, pensemos que el 9 de marzo, Anthony Fauci (director of the National Institutes of Health's National Institute of Allergy and Infectious Diseases) alertaba en la revista JAMA que EEUU necesitaba acelerar el paso para conseguir en las próximas dos semanas más de un millón de kits de diagnóstico para COVID-19.
3. El tercer aspecto, y quizás el más importante a medio plazo, se refiere al tratamiento terapéutico de la infección. Desgraciadamente es en este aspecto clave donde la situación es bastante mejorable. Ahora mismo, el tratamiento farmacológico que reciben los pacientes es puramente sintomático (p.ej., paracetamol). En ciertos hospitales, en los casos graves, se están tratando pacientes con los antivirales disponibles; aunque los resultados son decepcionantes. Es cierto que hay muchos laboratorios, en todo el mundo, trabajando contra reloj para el desarrollo de nuevos fármacos o una vacuna efectiva frente a COVID-19.
Ahora mismo, a nivel mundial, hay unos 70 estudios clínicos en marcha para el tratamiento del COVID-19. De estos estudios 46 están testando tratamientos farmacológicos, incluyendo terapias con células madre mesenquimales, antivirales (mayoritariamente combinación entre lopinavir y ritonavir, junto con interferón) y vacunas. Además, varios laboratorios están igualmente poniendo en marcha investigaciones para poder desarrollar vacunas y tratamientos que podrían iniciar el desarrollo clínico en breve. Sin embargo, es importante recordar que estos tratamientos tardarán (en el mejor de los casos) entre 12 y 18 meses en llegar al mercado ya que es crítico validar la eficacia y seguridad de estos tratamientos antes de administrarlos a los pacientes en la práctica clínica. Hay bastantes razones que permiten explicar este desfase temporal entre la necesidad acuciante actual y la potencial solución a meses/años vista. En primer lugar, un nuevo medicamento que se ponga en el mercado tiene que cumplir unos requisitos de eficacia y seguridad demostrables mediante ensayos clínicos, aparte de unos requisitos de calidad en cuanto a su fabricación industrial, que incrementan sustancialmente (en comparación con otros productos de alta tecnología) su desarrollo. Un segundo aspecto tiene que ver con el origen zoonótico (pasó de un huésped animal a uno humano) del patógeno. Esto no facilita una respuesta rápida y eficaz, al desconocerse todavía su mecanismo de acción y comportamiento.
Obviamente estas razones no deberían ser excusas para sacar lecciones y aplicar soluciones que pudieran mitigar las próximas epidemias. El COVID-19 no es el primer patógeno (ni será el último) en producir una pandemia, que es inevitable en un mundo interconectado. Hoy en día el número global de fallecimientos diarios por novovirus es 10 veces mayor que por coronavirus. En el caso de fallecimientos por rotavirus, la cifra de fallecimientos diarios es 20 veces superior. También es importante tener en cuenta que el disponer de un tratamiento o vacuna no es la panacea. Así, por ejemplo, las cifras de carga asistencial asociadas a la gripe estacional en España en la campaña 2018-2019 son muy significativas: 490.000 casos leves en atención primaria, 35.300 hospitalizaciones, 2.500 admisiones en UCI y 6.300 defunciones. Todo ello con la vacunación del 54% de los mayores de 65 años que permitió evitar, en ese grupo de edad, un 40% de admisiones en UCI y de defunciones.
Claro, estas emergencias sanitarias tienen lugar mayoritariamente en países con bajos y medianos ingresos. Nos hemos creído protegidos frente a este tipo de desgracias y la crisis actual nos demuestra que no es así. En las últimas décadas, hemos descuidado la investigación básica en biología e inmunología, así como el desarrollo de antiinfecciosos y vacunas. Es decepcionante constatar que no existen procedimientos rápidos y efectivos para desarrollar vacunas y que el número de adyuvantes (potenciadores o moduladores de inmunidad) aprobados para su uso en humanos es extremadamente bajo. Igualmente necesitamos potenciar los sistemas de fabricación y estocaje de productos sanitarios estratégicos para uso y protección del personal sanitario en este tipo de pandemias. Igualmente necesitamos sistemas y protocolos de alarma temprana y respuesta rápida que permita sistemas de contención eficaz. Y, por encima de todo, necesitamos aceptar que nuestras sociedades “desarrolladas” no viven aisladas en un mundo globalizado y que son vulnerables a muchos factores que no controlamos.
Esperanza Regueras y Juan M. Irache
Máster Universitario en Gestión de Empresas Pharma-Biotech
Universidad de Navarra